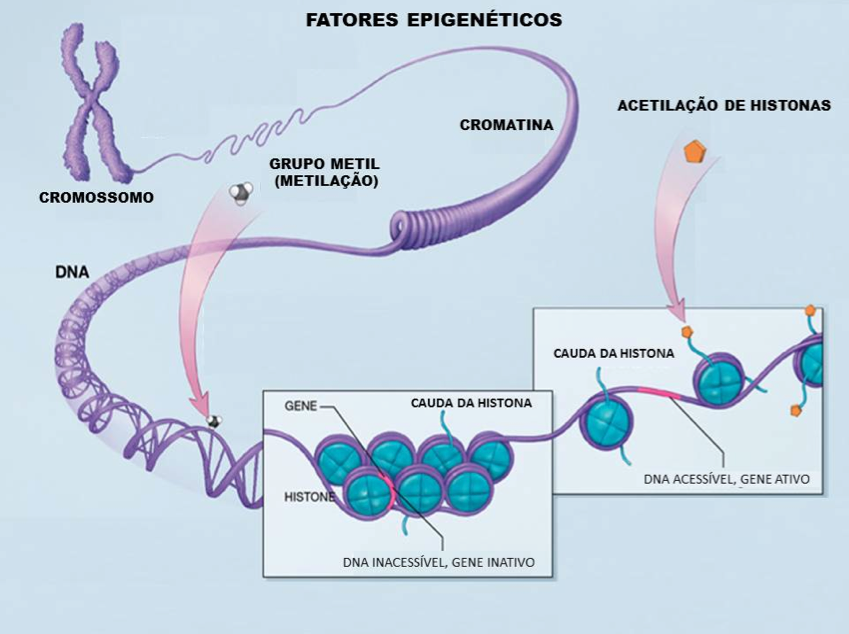
ALTERACIONES EPIGENÓMICAS DE LAS ENFERMEDADES CEREBROVASCULARES

Actualmente la epigenética se define como la información no ligada directamente a la secuencia de ADN que es heredable durante la división celular. Varios defectos del epigenoma conducen a enfermedad. Entre ellos están los trastornos en la metilación del ADN, la incorrecta modificación de las histonas, la distribución alterada de las proteínas que modifican la cromatina o la alteración de su función. Muchas enfermedades asociadas con alteraciones del epigenoma tienen en común un cambio de la plasticidad fenotípica entendida como la capacidad de las células para cambiar en respuesta a estímulos externos y/o internos.
En las enfermedades cerebrovasculares, la urbanización, la deficiente cultura nutricional (El efecto protector del polimorfismo rs13702 T>C en el lugar de unión del microARNs “reguladores epigéneticos” en el gen de la lipoproteinlipasas, se puede modular por la alimentación) y el sedentarismo que han determinado una “adaptación biológica”, se expresan por vía epigenética en substancias producidas por los músculos como pro-inflamatorias y resistentes a la insulina que aumentan la susceptibilidad a defectos metabólico.
Se ha investigado la relación entre los marcadores de estrés oxidativo y los marcadores de inflamación en pacientes con ictus isquémico. Pacientes con accidente cerebrovascular isquémico con concentraciones séricas de PCR-as mayores, indicativo de una mayor respuesta inflamatoria, también tenían niveles séricos de MDA superiores e inferiores TAS que aquellos con concentraciones séricas de PCR-as menores. Esto se puede observar en las figuras, que muestran que los niveles de hsCRP en suero se correlacionan positivamente con productos de la peroxidación de lípidos y se correlacionan negativamente con TAS.
Podemos llegar a la conclusión:
1. La edad presentó un predominio en las personas mayores de 65 años.
2. Se encuentra mayor frecuencia de ECV en el sexo femenino en relación al masculino.
3. Las formas clínicas: hemorragia intraparenquimatosa, subaracnoidea e isquémica tuvieron una distribución homogénea en este estudio.
4. La frecuencia global de los principales factores de riesgo como la presión arterial sistólica, diastólica, glucemia y lípidos, al obtener las medianas se observó que existe mayor significancia en los casos que en los controles.
5. La enfermedad cerebrovascular presenta asociación positiva con la HTA, DM2 y dislipidemia, siendo la HTA el factor de riesgo más asociado a la ECV.
6. Existe asociación estadística entre ECV isquémico y los factores de riesgoHTA, DM2 y dislipidemia.
PARA MAS INFORMACIÓN SOBRE LAS EPIGENETICA REVISA EL SIGUIENTE VIDEO
NOTICIA DE LA SEMANA!
REFERENCIA BIBLIOGRAFICA: